Uma nova vacina pré-clínica contra a malária vivax – forma da doença com maior distribuição geográfica e maior prevalência nas Américas – foi testada em camundongos e obteve 45% de eficácia, o que representa um importante avanço no desenvolvimento de alternativas de prevenção.
De acordo com dados da Organização Mundial da Saúde (OMS) de 2015, parasitas da espécie Plasmodium vivax foram responsáveis por mais de 13 milhões de casos de malária em todo o mundo e ainda não há um imunizante disponível contra esses patógenos.
A estratégia da nova vacina se baseia em desenvolver versões recombinantes de proteínas encontradas no esporozoíto – forma do parasita presente na glândula salivar do mosquito transmissor e que infecta o ser humano. A proteína em questão é homóloga à que está sendo usada em outra vacina em estágio mais avançado contra o Plasmodium falciparum, o parasita de malária mais comum no continente africano.
“Com base no sucesso dessa proteína de P. falciparum, pensamos em tentar algo parecido contra o parasita que acomete as Américas. Vê-se que na África a proteção também não é alta, de 30% a 40%, mas tem diminuído as formas graves da malária falciparum e atrasado o primeiro episódio de malária em crianças, reduzindo a mortalidade infantil”, disse Irene Soares, professora da Faculdade de Ciências Farmacêuticas (FCF) da USP e autora correspondente do artigo com resultados da pesquisa publicado na revista Frontiers in Immunology.
A candidata à vacina contra o P. falciparum, a RTS,S/AS01, já passou por testes clínicos de fase 3 – a pesquisa clínica é usualmente classificada em quatro fases – e recebeu uma sinalização positiva da OMS para um estudo piloto de implementação. De acordo com a professora, a vacina não será para uso geral na população. “Talvez para crianças e pessoas não imunes, como viajantes que vão para a região endêmica. É uma forma de não ter essas formas graves da doença”, disse Irene Soares.
A iniciativa de desenvolver uma vacina contra o P. vivax partiu de um grupo de pesquisadores do Centro de Terapia Celular e Molecular da Universidade Federal de São Paulo (Unifesp) e da FCF-USP. O projeto é apoiado pela Fapesp no âmbito de um Projeto Temático e contou com a colaboração de uma equipe internacional, com pesquisadores do Instituto Pasteur (França) e da Agency for Science Technology and Research (Singapura), entre outros.
O P. vivax tem particularidades que dificultam o desenvolvimento de vacinas. Diferentemente do parasita mais comum do continente africano, a proteína-alvo do P. vivax tem três formas alélicas, ou seja, três variantes na natureza chamadas de VK210, VK247 e P. vivax-like. Trabalhos prévios realizados nas décadas de 1990 e 2000 mostraram que as três variantes circulam pelo Brasil, com prevalência da VK210.
A proteína circumsporozoíta (CS), a mais abundante na superfície do parasita, é velha conhecida da ciência, tendo sido caracterizada pelos pesquisadores brasileiros Ruth e Victor Nussenzweig, da New York University, a partir da década de 1960.
A molécula está envolvida nos estágios iniciais de invasão de células do fígado de mamíferos infectados. Isso faz com que ela seja um alvo importante para anticorpos e outras células do sistema imunológico.
“Como a proteína do P. vivax tem três formas alélicas, fizemos também uma versão híbrida com essas três variantes reunidas. Ela contém um pedaço de cada uma. Caso a vacina fosse baseada em uma única variante, ela não protegeria contra as outras e não teria boa abrangência”, disse Irene.
Após produzir a proteína fusionada, os pesquisadores partiram para a etapa de induzir anticorpos contra as três variantes. Mas, para saber se os anticorpos reconheciam o parasita, a equipe contou com a colaboração de pesquisadores da Agency for Science Technology and Research, de Singapura.
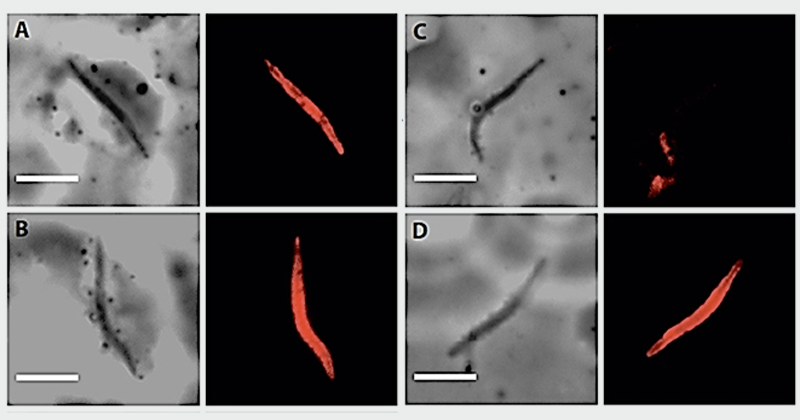
A agência cedeu os esporozoítos extraídos da saliva do mosquito. Nos testes, os anticorpos gerados – tanto a mistura de proteínas quanto a proteína de fusão – foram capazes de reconhecer a molécula nativa por imunofluorescência.
O teste em animais contou com mais um desafio: camundongos não são infectados pelo P. vivax. Para resolver o problema, a equipe contou com a colaboração do Instituto Pasteur, onde foi testado um parasita transgênico – o esporozoíto do Plasmodium berghei (que infecta o camundongo) capaz de expressar as repetições da proteína VK210 de P. vivax (Pb / PvVK210).
“É por isso que o artigo tem vários autores, de diferentes centros de pesquisa. Foi um trabalho muito complexo e com várias etapas”, contou Irene.
No laboratório de Rogerio Amino, pesquisador brasileiro do Instituto Pasteur e coautor do estudo, os camundongos que receberam a formulação da vacina foram protegidos contra a infecção de esporozoítos quiméricos de P. berghei, expressando repetições de proteína do circumsporozoíto de P. vivax.
“Foi uma colaboração importante. Os animais receberam três doses da vacina híbrida e depois foram desafiados com o parasita transgênico. Quatro dos seis camundongos imunizados estavam livres da infecção até o décimo dia após o desafio, enquanto todos os animais do grupo controle (não imunizados) ficaram infectados após quatro dias”, disse Irene Soares.
De acordo com a pesquisadora, ainda faltam etapas a cumprir até que a vacina se mostre comercialmente interessante e possa ser uma alternativa contra o P. vivax. O imunizante ainda precisa, por exemplo, ser testado em outros mamíferos antes da etapa de ensaios clínicos.
A primeira autora do artigo, Alba Marina Gimenez, do Centro de Terapia Celular e Molecular da Unifesp, realizou recentemente um estágio na University of Oxford, no Reino Unido, onde teve a oportunidade de testar parasitas transgênicos capazes de expressar cada uma das três variações da proteína (alelos VK210, VK247 e P. vivax-like). O trabalho teve apoio da Fapesp.
Parasitas dormentes
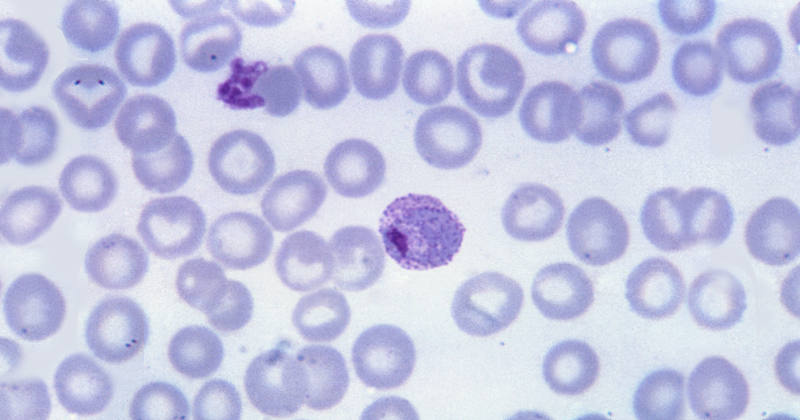
Um dos grandes desafios da nova vacina é conseguir combater também os parasitas que, passada a fase aguda, permanecem no fígado na forma dormente e podem desencadear outro episódio da doença meses depois de o paciente ser infectado. Essa é outra particularidade do P. vivax.
“Quando o mosquito pica, uma parte dos parasitas inoculados adquire uma forma dormente (hipnozoíto) no fígado, enquanto a outra parte vai causar a doença. Portanto, quando os patógenos no sangue são tratados, aqueles que estão ‘dormindo’ continuam prontos para atacar novamente. O remédio pode funcionar no primeiro momento, mas, depois de alguns meses, o parasita pode ‘acordar’ e voltar à circulação sanguínea, causando recaída”, disse Amino, coautor do estudo.
Amino é também um dos autores de um trabalho publicado na Trends in Parasitology, segundo o qual uma vacina contra esporozoítos de P. vivax com moderada eficácia contra a infecção primária poderia reduzir substancialmente a transmissão de hipnozoítos, evitando recaídas.
“Seria muito interessante se houvesse uma vacina que diminuísse significativamente o número de hipnozoítos, ainda que não fosse 100% eficaz contra a primo-infecção. A vacina que está sendo desenvolvida contra o P. vivax tem uma boa eficácia, mas ainda não foi testado se pode ou não diminuir as recaídas. Se ela funcionar também contra os hipnozoítos será um grande avanço”, disse.
O artigo Vaccine Containing the Three Allelic Variants of the Plasmodium vivax Circumsporozoite Antigen Induces Protection in Mice after Challenge with a Transgenic Rodent Malaria Parasite, de Alba Marina Gimenez, Luciana Chagas Lima, Katia Sanches Françoso, Priscila M. A. Denapoli, Raquel Panatieri, Daniel Y. Bargieri, Jean-Michel Thiberge, Chiara Andolina, Francois Nosten, Laurent Renia, Ruth S. Nussenzweig, Victor Nussenzweig, Rogerio Amino, Mauricio M. Rodrigues e Irene S. Soares, pode ser lido na Frontiers of Immunology.
Maria Fernanda Ziegler / Agência Fapesp (Leia aqui matéria original)