A pesquisa começou com dois cães Golden Retriever com distrofia muscular que, surpreendentemente, escaparam da doença. Eles fazem parte do modelo animal estudado pelo Centro de Pesquisa sobre o Genoma Humano e Células-Tronco e levaram à descoberta de uma alteração genética que promove a compensação a doença. No futuro, essa descoberta poderá ser a base de um novo tratamento para quem sofre com a distrofia muscular de Duchenne.
Ringo e Suflair, dois cães da raça Golden Retriever tratados pela equipe da bióloga Mayana Zatz, da USP, foram diagnosticados com distrofia muscular desde que eram filhotes. Ao longo da vida, porém, não tiveram quase nenhum sintoma da doença. Depois de mais de 8 anos investigando o que protege a musculatura desses cachorros, os pesquisadores encontraram um responsável: o gene Jagged1. Em Ringo e Suflair, esse gene está mais ativado e produz mais proteínas que o normal. Isso desencadeia um mecanismo que ajuda a mascarar a distrofia.
Assista ao vídeo dos dois cães brincando
O achado é inédito e surpreendente, já que revela que é possível haver um músculo funcional em um animal de grande porte, apesar da distrofia muscular. Os cães Golden Retriever são o modelo animal mais parecido com nós, humanos, e suportam cargas comparáveis às que carregamos. Além disso, pela primeira vez, descobriu-se uma associação entre o gene Jagged1 e a doença. A pesquisa foi publicada online neste dia 12 de novembro pela revista científica Cell, e estará na edição impressa do dia 19. A Cell é o periódico de maior índice de impacto nas áreas de biologia molecular e bioquímica, de acordo com a medição Thomson-Reuters.
O título do artigo, Jagged1 Rescues the Duchene Muscular Dystrophy Phenotype, pode ser traduzido como Jagged1 resgata o fenótipo da Distrofia Muscular de Duchenne (tradução livre). Leia a publicação, disponível para assinantes.
A distrofia muscular
A distrofia é causada por uma falha no gene que produz a distrofina, uma proteína fundamental para manter a fibra muscular inteira. A falta dessa proteína leva à perda progressiva de musculatura, inclusive do coração e do diafragma, músculo responsável pela respiração.
Em pessoas, a forma mais grave – e mais frequente – da doença é a distrofia muscular de Duchenne, em geral diagnosticada em meninos aos 3 ou 4 anos de idade. Com cerca de 12 anos, a maioria dos garotos não consegue mais andar. A degeneração muscular continua, levando à morte precoce.
O problema atinge 1 a cada 3,5 a 5 mil meninos – incidência quatro vezes maior que a de leucemias entre garotos de 0 a 19 anos, e só comparável à frequência de todos os cânceres infantis somados. (dados para São Paulo do último levantamento realizado pelo Instituto Nacional do Câncer, em 2008).
São raríssimos os casos em meninas, porque o gene da distrofina está no cromossomo X e elas precisariam herdar os dois cromossomos com defeito. Isso é praticamente impossível, já que homens com Duchenne não se tornam pais – por morte precoce ou falta condições físicas. Outra possibilidade é haver uma troca de genes entre o cromossomo X e outro cromossomo, ainda no óvulo que deu origem à menina. Situações assim já foram reportadas.
A distrofia de Duchenne ainda não tem cura e os cuidados disponíveis são apenas paliativos, como fisioterapia e remédios à base de corticoides.
Veja a explicação de Mayana Zatz sobre as distrofias musculares
A descoberta do estudo abre novas possibilidades de alvos terapêuticos, a partir de intervenções ou medicamentos que reproduzam, nos meninos afetados, o mesmo efeito de compensação provocado pelo gene Jagged1 nos cães que escaparam da doença. Atualmente, pesquisadores que buscam tratamentos para esse tipo grave de distrofia tentam impedir a degeneração muscular – ou seja, olham para a falta da distrofina – mas ainda não obtiveram sucesso.
Trabalho em equipe

A primeira autora do artigo da Cell é Natássia Vieira, que começou sua carreira de pesquisadora orientada por Mayana Zatz, ainda durante a graduação no Instituto de Biociências da USP. Também assinam o trabalho, como idealizadores dos experimentos relatados no paper, Mayana Zatz e Juliana Gomes, do Centro de Pesquisa sobre o Genoma Humano e Células-Tronco (Hug-Cell); Sergio Verjovski-Almeida e Yuri Moreira, do Departamento de Bioquímica, do Instituto de Química da USP (IQ).
O grupo brasileiro estabeleceu uma colaboração com cientistas da Escola de Medicina de Harvard, do Broad Institute (de Harvard e do Instituto de Tecnologia de Massachusetts – MIT) e do Boston Children’s Hospital, dos Estados Unidos. Eles desenvolveram etapas fundamentais da pesquisa liderados Louis Kunkel, um dos descobridores da distrofina e de sua ligação com a doença de Duchenne, na década de 80.
A pedido de CiênciaUSP, a geneticista Anamaria Aranha Camargo, que não participou do estudo, analisou o artigo. Ela é coordenadora do Centro de Oncologia Molecular do Instituto Sírio Libanês de Ensino e Pesquisa e integrou o Projeto Genoma Humano do Câncer. “Pela multiplicidade de técnicas utilizadas, cada uma complementando as outras, posso dizer que as conclusões do artigo são totalmente sustentadas pelos experimentos realizados”, diz.
Modelos Animais
Alguns animais que não produzem distrofina são usados como modelos para os estudos da distrofia muscular. No mundo, o mais presente nos laboratórios é o modelo do camundongo MDX, útil para pesquisar o que acontece dentro das células e testar se um tratamento age na produção de distrofina. Ele tem, porém, uma limitação: como não apresenta sintomas da doença nos músculos, nem expectativa de vida reduzida, não é capaz de mostrar se o tratamento tem efeitos clínicos – se recupera a força muscular ou diminui a gravidade da doença, por exemplo. Um outro camundongo, descoberto recentemente, apresenta sintomas graves e começou a ser usado para verificar a eficácia de medicamentos.

O segundo modelo é o zebrafish sapje, um peixe paulistinha deficiente em distrofina. Nesses, ainda na fase de larvas, é possível ver ao microscópio as fibras musculares rompidas e desorganizadas. Eles quase não se movem e morrem com poucas semanas, enquanto um peixe sem doença vive por 2 anos. Esse modelo é prático porque é possível fazer manipulação genética nos ovos, os resultados aparecem rapidamente e são visíveis ao microscópio. A ressalva é que estão mais distantes dos seres humanos na comparação entre as espécies.
O último animal é o Golden Retriever com distrofia muscular (GRMD, na sigla em inglês). Esses cães têm sintomas muito semelhantes aos dos meninos com Duchenne, como a degeneração dos músculos, contraturas e níveis elevados da proteína creatinoquinase. Essa é uma enzima que cai na circulação sanguínea quando a célula muscular morre e, por isso, serve para medir a quantidade de musculatura perdida. Os cães também sustentam uma massa corporal similar à dos pacientes. Por todos esses aspectos, são o modelo ideal para verificar se os tratamentos devem ou não ter efeitos em seres humanos. O aspecto negativo é o custo alto para cuidar dos cachorros. Desde 2003, A equipe de Mayana Zatz já avaliou 82 Golden Retriever e 39 deles foram diagnosticados com distrofia muscular.
Acompanhe também a linha do tempo da pesquisa sobre distrofia muscular
Atenção ao acaso: Ringo

A pesquisa publicada hoje começou com um acaso que teria passado despercebido se não tivesse ocorrido nos animais tratados pelo Centro do Genoma. Em 2003, entre os cães com distrofia muscular, um nasceu mais ativo, sem a fraqueza e a apatia dos irmãos. Os cientistas do grupo testaram o DNA de Ringo no laboratório e constataram que, apesar da falta de sintomas, o Golden Retriever carregava o mesmo defeito no gene da distrofina que os outros cães afetados pela doença.
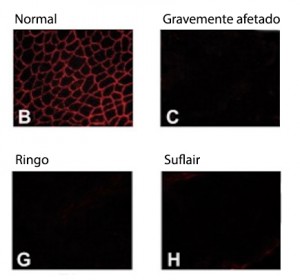
Talvez os músculos de Ringo produzissem distrofina mesmo com o gene defeituoso, pensaram Mayana e sua equipe. Alguns meses depois, foi possível retirar uma pequena amostra do músculo do cão e, para a surpresa de todos, não encontraram nada de distrofina. No microscópio, também não era possível enxergar as membranas das fibras musculares, exatamente como acontece nos cachorros doentes.
Nunca tinha sido reportado no mundo o caso de um cão sem distrofina que fosse capaz de andar e correr normalmente, além de ter a sobrevida esperada para a espécie. Ringo viveu até os 11 anos de idade, enquanto os parentes mais afetados pela distrofia muscular não passavam dos dois anos. Veio então a pergunta: o que torna Ringo tão especial?
Suflair: a solução é genética
Uma pista surgiu em 2006. Ringo cruzou com quatro fêmeas e, em uma das ninhadas, nasceu Suflair. Ele tem as mesmas características do pai: possui a alteração no gene da distrofina, mas se movimenta como cães sem a doença. Ficou claro que a solução deles para a distrofia era genética e tinha sido passada de pai para filho.

A questão ficou mais específica: quais genes protegem os músculos de Ringo e Suflair?
Os 66 genes
Em 2008, Natássia Vieira assumiu a frente dos estudos, orientada por Mayana Zatz. Elas procuraram o professor Sérgio Verjovski-Almeida, do Laboratório de Expressão Gênica em Eucariotos do Instituto de Química da USP. O laboratório é especializado em um exame chamado microarray de RNA, ou micro-arranjo, capaz de indicar quais genes estão funcionando em um determinado grupo de células – no caso, o músculo de Ringo e Suflair.
O princípio é o seguinte: dentro do núcleo, todas as células do corpo possuem o DNA completo, com genes que determinam funções tão distintas quanto a produção de suco gástrico para a digestão e de queratina para as unhas. Mas uma única célula não precisa executar todas as ações do corpo, portanto, nessa célula, alguns genes estão “desligados”. Em compensação, os genes que estão “ativados” produzem proteínas para que ela sobreviva e faça suas atividades.
No caminho para gerar uma proteína, é construído um RNA mensageiro. Ele é uma cópia das informações do gene e é capaz de sair do núcleo da célula para chegar ao ribossomo – a estrutura responsável por “montar” a proteína.
O microarray de RNA identifica os RNAs mensageiros – consequentemente, os respectivos genes que estão produzindo proteínas. No exame, o RNA é extraído das células, tratado e colocado em uma placa que têm pedaços de todos os genes conhecidos de cachorro. Os RNAs se ligam aos seus genes correspondentes. Em seguida, a placa é escaneada e as imagens são processadas no computador. Nas imagens, as áreas em preto correspondem aos genes que não tiveram “match” com um RNA, ou seja, estão “desligados”. Os pontos coloridos indicam que lá os RNAs grudaram – são os genes “ativados”. A intensidade da cor indica se estão produzindo muita ou pouca proteína.
Quando Yuri e Sérgio compararam os exames de Ringo e Suflair aos de 4 cães normais e 4 cães com quadro grave de distrofia, chegaram a uma lista de 66 genes que estavam diferentes nos dois cachorros especiais. Pelo raciocínio, a solução para a distrofia muscular tinha que estar nessa lista. Como é inviável testar todos – por limitação financeira e de tempo –, o grupo de pesquisadores escolheu um gene que parecia o mais provável, no cromossomo 9 dos cães.
Colaboração com Harvard

Para testar se era o gene certo, Mayana Zatz pediu uma colaboração ao pesquisador Louis M. Kunkel, do Departamento de Genética e Genômica do Boston Children’s Hospital e da Escola de Medicina da Universidade de Harvard, nos EUA. Desde a década de 1990, Mayana e Kunkel fazem trabalhos juntos.
Natássia viajou a Boston e começou os testes no modelo animal do peixe paulistinha. Um trabalho meticuloso: a pesquisadora precisou inserir em centenas de ovos um material chamado morfolino, que regula a atividade do gene para o mesmo nível registrado em Ringo e Suflair.

A resposta esperada era que os peixes crescessem com as fibras musculares ordenadas, livres dos sintomas de distrofia. Depois de 9 dias, quando as larvas foram analisadas ao microscópio, os músculos pareciam “esburacados”, com falhas visíveis.
O resultado foi desanimador. “Esse gene até fez alguma diferença, só que ninguém ficou convencido, porque o cachorro estava muito bem e os peixes estavam mais ou menos”, diz Natássia.
Cromossomos 24, 33 e 37: grande frustração
Com um convite para fazer o pós-doutorado em Boston, Natássia continuou as investigações. Enquanto insistia nos testes com o peixe paulistinha, entrou em contato com Kerstin Lindblad-Toh, geneticista da Universidade de Uppsala, na Suécia, e coordenadora das pesquisas com vertebrados no Broad Institute – um projeto conjunto de Harvard e do Instituto de Tecnologia de Massachusetts (MIT). Kerstin era uma das poucas cientistas no mundo que estava desbravando o genoma canino, com intuito de traçar a evolução das raças de cães.

Natássia queria mais informações para se certificar de que estava no caminho certo ao apostar em um gene do cromossomo 9. Faltava a ela, porém, o conhecimento para trabalhar com o genoma de cachorros. A cientista sueca aceitou ajudar. A estratégia definida foi buscar quais regiões estavam alteradas nos cromossomos de Ringo e Suflair, comparando com 31 cães da mesma família que tinham sintomas da distrofia.
Células dos 33 cachorros foram submetidas a um SNP array – um mapeamento genético que mostra áreas com mudanças significativas no DNA de cada cão. A interpretação envolveu estudos de linkagefamiliar e de associação genômica ampla (GWAS, na sigla em inglês). As duas técnicas servem para comparar os dados dos cães. Como resultado, as pesquisadoras detectaram que Ringo e Suflair têm as mesmas alterações nos cromossomos 24, 33 e 37 – e essas variações não estão nos outros cães. Nada especial foi detectado no cromossomo 9. A investigação de Natássia voltou praticamente à estaca zero
“Me dá um arrepio só de lembrar. Para mim foi uma tristeza, mas eu pensei: vou com isso até o fim.”, conta.
Nova esperança: o Jagged1
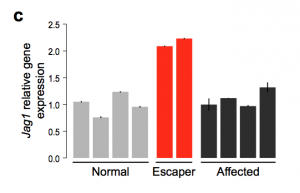
Para sair do impasse, o grupo voltou ao resultado do microarray de RNA, feito no laboratório do professor Sérgio Verjovski-Almeida. Na lista dos 66 genes com possibilidade de explicar a compensação da distrofia muscular, nenhum faz parte dos cromossomos 33 e 37. Do cromossomo 24, há apenas um: o Jagged1. Pela análise de Yuri Moreira, esse gene produz duas vezes mais proteínas no Ringo e no Suflair do que nos cães normais ou nos afetados.

Em Boston, Natássia retomou os testes com peixes paulistinha, desta vez aumentando a atividade do gene Jagged1. No modelo animal, os peixes do aquário têm defeito em apenas um gene da distrofina, ou seja, são “Aa” (“azão”/”azinho”) ou “+/-“ (positivo-negativo), para usar a linguagem da genética ensinada nas escolas. O cruzamento de dois desses peixes gera em média 25% de animais AA (+/+), sem qualquer traço da doença; 50% de animais Aa (+/-), que só carregam um gene afetado; e 25% aa (-/-), que têm a distrofia e morrem após poucas semanas.
Os números mudaram quando foram manipulados geneticamente para dobrar a produção da proteína Jagged1. Nesse cruzamento, apenas 6% dos peixes nasceram com fibras musculares desorganizadas. Os outros 19% que tinham a combinação genética aa (-/-), e deveriam ser distróficos, estavam com aspecto normal e até conseguiam nadar. O experimento foi repetido 4 vezes, com resultados semelhantes.
“Foi uma prova funcional de que o Jagged1 é o gene que explica o quadro clínico dos dois cachorros”, afirma Mayana Zatz. Louis Kunkel é mais cauteloso: “Tenho 98% de certeza. Para chegar aos 100%, quero confirmar esses resultados também no modelo dos camundongos”, diz.
Mais uma dúvida
Ainda em busca de esclarecimentos, os cientistas procuraram a causa para o gene Jagged1 estar mais ativado no Ringo e no Suflair. Esse desafio exigiu um exame caro e difícil de ser interpretado: o sequenciamento completo do genoma dos cães.
O sequenciamento permite conhecer cada base nitrogenada que compõe o DNA. Nos seres humanos, são cerca de 3 bilhões de pares de bases, que formam mais de 20 mil genes. Só o gene da distrofina, o maior do corpo humano conhecido até hoje, tem 2,3 milhões de bases. É o encadeamento delas que determina quais aminoácidos vão compor as proteínas.
No caso do genoma dos cachorros, até então não havia bancos de dados com informações completas sobre as combinações de bases e suas funções nesses animais. Mesmo assim, Kerstin topou fazer o sequenciamento completo do DNA de três cães: Ringo, Suflair e um parente com sintomas graves de distrofia muscular. O objetivo foi ver as variações na sequência de bases que poderiam explicar por que os dois cachorros têm mais proteína do Jagged1.
Confira o infográfico com as informações obtidas na pesquisa.
Os resultados mostraram milhões de alterações entre os cães. A cientista sueca forneceu os mapeamentos que já havia feito em outros cachorros para eliminar as variações comuns de ocorrer entre os indivíduos. Ainda sobraram muitas. Os pesquisadores resolveram focar apenas na área próximo ao gene Jagged1, no cromossomo 24. Acharam 1.300 diferenças. E como saber o que cada uma delas faz? Para isso, usaram programas de computador que associam os dados dos cachorros ao dados do genoma humano.
O esforço deu resultado. Na área responsável por “ligar” o gene de Ringo e Suflair, encontraram a troca de uma base nitrogenada. Essa pequena alteração tem um efeito decisivo, porque cria um ponto para uma proteína chamada miogenina se ligar ao DNA.
A explicação
A miogenina é constantemente produzida pelas células musculares e age como um fator de ativação de genes. Também é relacionada a mecanismos de reparo do músculo.
Na última fase da investigação, os pesquisadores fizeram testes com camundongos, células humanas e células de cachorros. Eles mostraram que a miogenina é diretamente responsável pelo aumento da produção de Jagged1; e que as células do músculo de Ringo e Suflair se multiplicam mais rapidamente que a dos outros cães.
A hipótese formulada pelos cientistas, a ser verificada nos próximos trabalhos, é que a proteína Jagged1 provoque uma reação em cadeia que estimula a divisão da própria célula ou das células vizinhas. Com mais produção dessa proteína, os músculos dos cachorros especiais conseguiriam se recompor mais rapidamente do que se degeneram por causa da distrofia. Talvez seja isso que mantem a musculatura funcionando e permite que os cães atinjam a expectativa de vida normal para a raça.

A professora Anamaria Camargo, que não está envolvida nos trabalhos, sugere usar o exemplo dos cães tratados no Centro do Genoma para mostrar a importância dos modelos animais. “Eu imagino que estudar e tratar esses animais seja difícil e pouco valorizado. Mas, se não existisse esse esforço, nunca teriam sido detectados esses cachorros e as descobertas não teriam acontecido”, diz.
A busca pelo futuro
Mayana Zatz acredita que o mecanismo do Jagged1 abra a possibilidade de buscar tratamentos para a distrofia muscular de Duchenne por outras vias. “Essa abordagem vai quebrar um paradigma, porque o mundo inteiro está focado em recuperar a distrofina no músculo. Infelizmente, esses trabalhos não estão mostrando resultados animadores. A grande vantagem do caminho do Jagged1, se funcionar, é que poderemos regenerar o músculo mesmo que ele continue sem distrofina”.
Kunkel imagina que o controle da distrofia será feito de forma complementar pelas duas vias. “Para os pacientes com Duchenne, há novas esperanças. Essa é a década do tratamento”, completa.

O Centro de Pesquisa sobre o Genoma Humano e Células-Tronco, da USP, e o laboratório de Louis Kunkel, em Boston, já começaram as buscas por medicamentos que possam regenerar o músculo do mesmo modo que o Jagged1. Natássia e Mayana consideram ainda a possibilidade de usar terapias com células-tronco ou intervenções genéticas. Quando for encontrada uma fórmula promissora, ela deverá ser testada em camundongos, em peixes, em cães e em células humanas antes de receber permissão para seguir em ensaios clínicos com seres humanos.
Por isso, os eventuais tratamentos futuros ainda estão longe de chegar aos consultórios médicos.
Paralelamente, as pesquisadoras brasileiras estão fazendo um levantamento entre os meninos com quadros mais leves de distrofia muscular para verificar se eles também têm a produção de Jagged1 aumentada. Se confirmado, será um bom indicativo de que estão no caminho certo na busca de um controle para a doença de Duchenne.
A pesquisa e os pesquisadores foram financiados por:
Fapesp-Cepid, CNPq, INCT e AACD; Duchenne Foundation, The Bernard F. and Alva B. Gimbel Foundation, National Institute of Health-EUA, Swedish Research Council, ERC (European Research Council) e Muscular Dystrophy Association.