No Instituto de Ciências Biomédicas (ICB) da USP, pesquisa identificou uma enzima capaz de alterar as propriedades dos aminoglicosídeos, moléculas produzidas por bactérias e usadas na medicina como antibióticos. A enzima atua no processo de formação das moléculas de antibióticos como a gentamicina, a canamicina e a tobramicina, fazendo-os superar a resistência de micro-organismos causadores de infecções. A descoberta poderá levar à produção, por vias naturais, de antibióticos mais eficazes e com menos toxicidade.
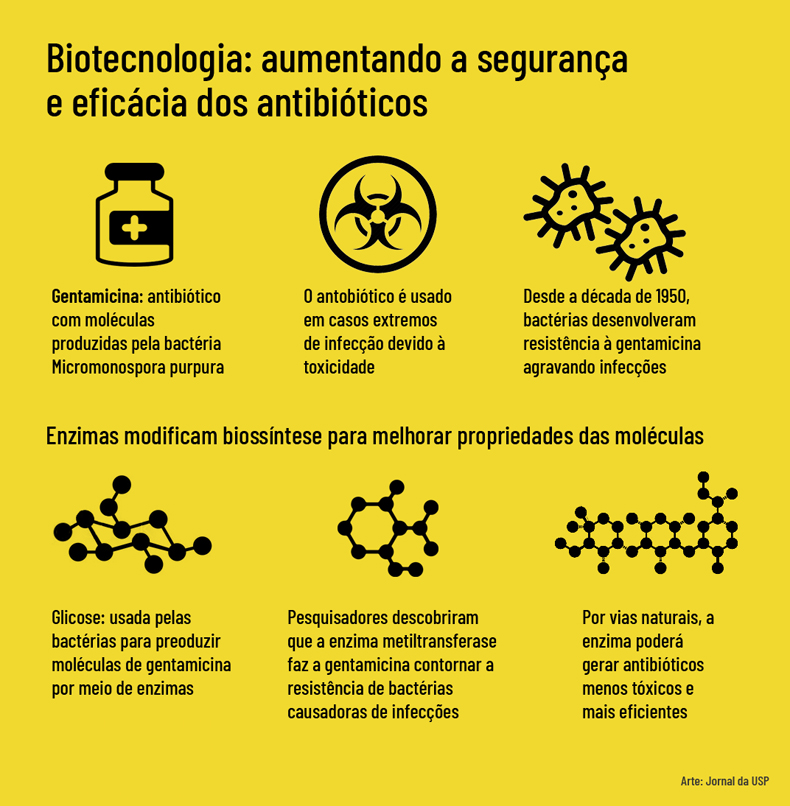
O antibiótico estudado na pesquisa é a gentamicina, produzida pela bactéria Micromonospora purpurea. “Essa bactéria faz parte de um grupo chamado actinomicetos, que possuem enzimas capazes de transformar a glicose em moléculas usadas como mecanismo de defesa contra outros micro-organismos”, relata o professor Marcio Vinícius Bertacine Dias, que coordena a pesquisa. A glicose transformada pelas enzimas dá origem ao antibiótico. “A gentamicina faz parte do grupo dos aminoglicosídeos, antibióticos derivados da glicose, e o primeiro desse tipo a ser descoberto e usado como medicamento foi a estreptomicina, que foi amplamente utilizada no tratamento da tuberculose”.
Bertacine Dias afirma que os estudos de biologia estrutural ajudam a entender a biossíntese de antibióticos. “Apesar de serem usados clinicamente, muitos apresentam problemas de toxicidade, e também há um grande número de casos de resistência a antibióticos, uma vez que são utilizados desde a década de 1950”, destaca. “Entender a biossíntese, ou seja, como as bactérias produzem antibióticos, permitirá propor mudanças que contornem a resistência e diminuam a toxicidade”.
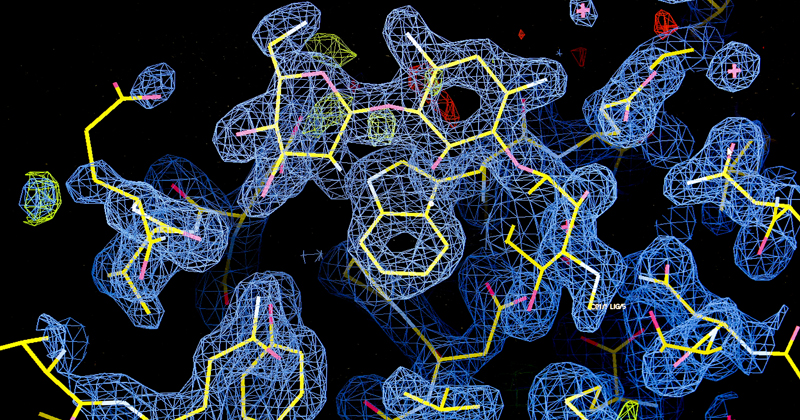
As enzimas são proteínas que catalisam reações químicas essencias para vida ou para a biossíntese de compostos. “No caso da metiltransferase, uma das enzimas envolvidas na biossíntese da molécula da gentamicina, testada na pesquisa, ela catalisa a transferência de um grupo metila de uma “co-enzima” (espécie de vitamina) para as moléculas dos aminoglicosídeos”, explica o pesquisador. “Essa reação, apesar de parecer simples, seria sinteticamente complicada, mas a natureza consegue fazê-la rapidamente e eficazmente com o uso desta enzima”.
.
Biossíntese
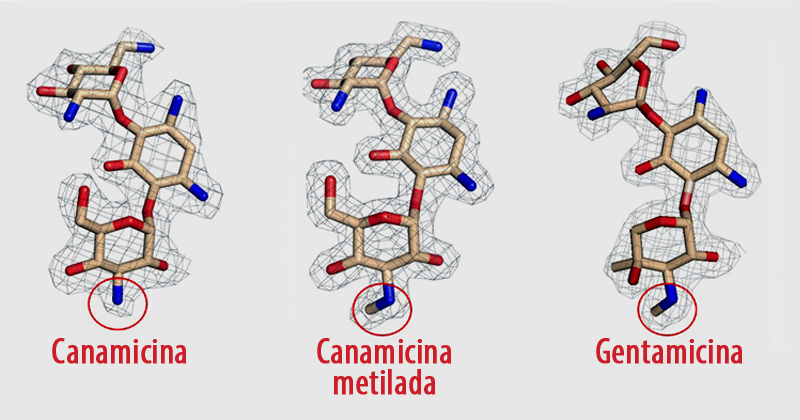
O estudo observou que uma metiltransferase, além de metilar a gentamicina, ou seja, alterar a gentamicina natural presente na bactéria também metila outros aminoglicosídeos, como a canamicina e tobramicina. “Essa metilação causa uma alteração que permite a molécula contornar mecanismos de resistência, o que abre a perspectiva de gerar antibióticos menos tóxicos e mais eficazes contra bactérias resistentes”, ressalta o professor.
Atualmente, devido à toxicidade, a gentamicina é utilizada apenas em casos graves de infecção, como último recurso, através de doses injetáveis. “Também há uma tendência de uso dos aminoglicosídeos para tratar doenças genéticas, pois eles inibem a síntese proteica realizada pelos ribossomos”, diz Bertacine Dias. “A canamicina era usada contra bactérias gram-negativas, causadoras de infecções urinárias e sepse, mas deixou de ser adotada desde a década de 1990, devido ao aumento da resistência das bactérias ao antibiótico e sua toxicidade”.
De acordo com o professor do ICB, os estudos sobre biossíntese tem aumentado nos últimos anos para ampliar os conhecimentos sobre engenharia biossintética de produtos naturais, caso dos antibióticos produzidos por bactérias. “São moléculas obtidas pela fermentação das bactérias, difíceis de serem produzidas em laboratório. Por meio da manipulação das enzimas, pode-se modificar as moléculas e melhorar os antibióticos”, diz. “É uma estratégia promissora para ser usada em paralelo com as técnicas tradicionais de química orgânica, aplicadas hoje em dia para a modificação de antibióticos, mas que podem gerar resíduos tóxicos para o meio ambiente”.

“Os estudos de biologia estrutural contribuem para entender como as enzimas modificam a estrutura dos antibióticos, a fim de propor mudanças nas enzimas que aumentem sua interação com outros aminoglicosídeos e proporcionem um potencial biotecnológico maior”, conclui Bertacine Dias. A pesquisa é parte da tese de doutorado de Priscila Bury, que realizou o estudo no Laboratório de Biologia Estrutural Aplicada do ICB. O trabalho tem a colaboração de pesquisadores das universidades de Cambridge (Reino Unido) e Wuhan (China) e foi publicado na revista ACS Chemical Biology.
Mais informações: e-mail mvbdias@usp.br, com o professor Márcio Vinícius Bertacine Dias
.
.
.