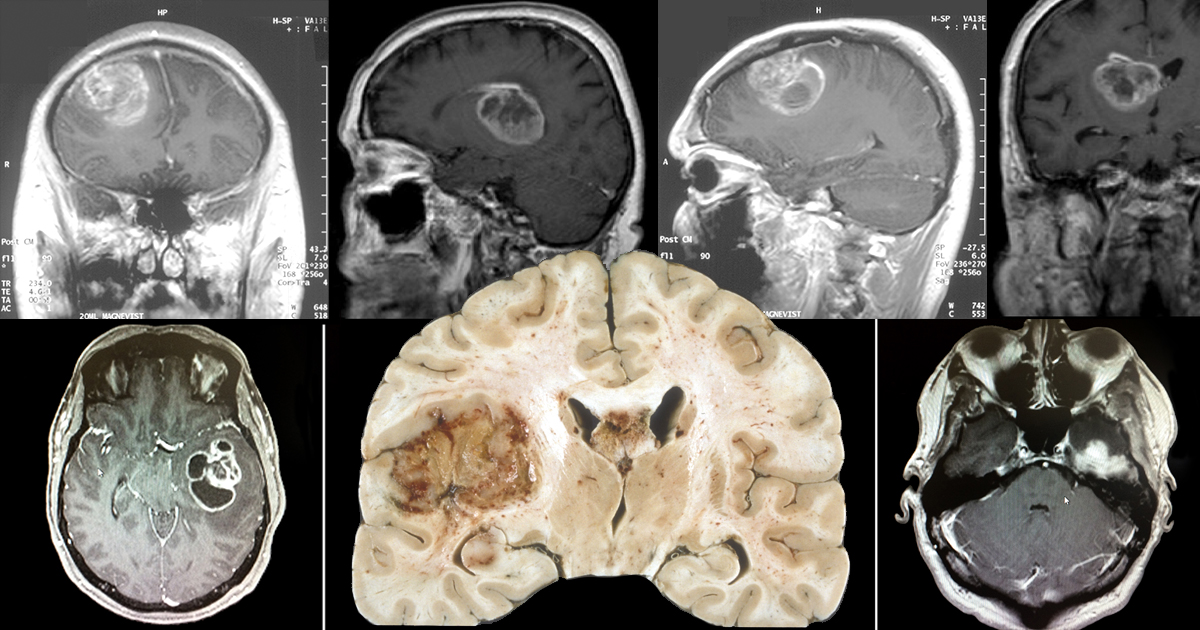
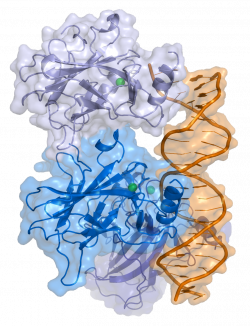
Para os próximos passos da pesquisa, Yuli Magalhães conta que o foco de seu pós-doutorado será avaliar a aplicabilidade dos resultados encontrados em modelos animais, a fim de verificar a eficácia do mecanismo proposto em um modelo vivo e mais complexo. Com isso, espera-se expandir as descobertas para uma futura aplicação clínica, que possa levar a uma sobrevida maior e com mais qualidade aos pacientes acometidos pelo glioblastoma.
Mais informações: e-mail yuli_thamires@hotmail.com, com Yuli Magalhães; e-mail flforti@iq.usp.br, com Fabio Forti
*Da Assessoria de Comunicação do Instituto de Química, editado por Fabiana Mariz
**Estagiária sob orientação de Moisés Dorado