Blog
Estudo revela segredos de molécula usada em um terço dos medicamentos
14/08/2020
Por Julio Bernardes
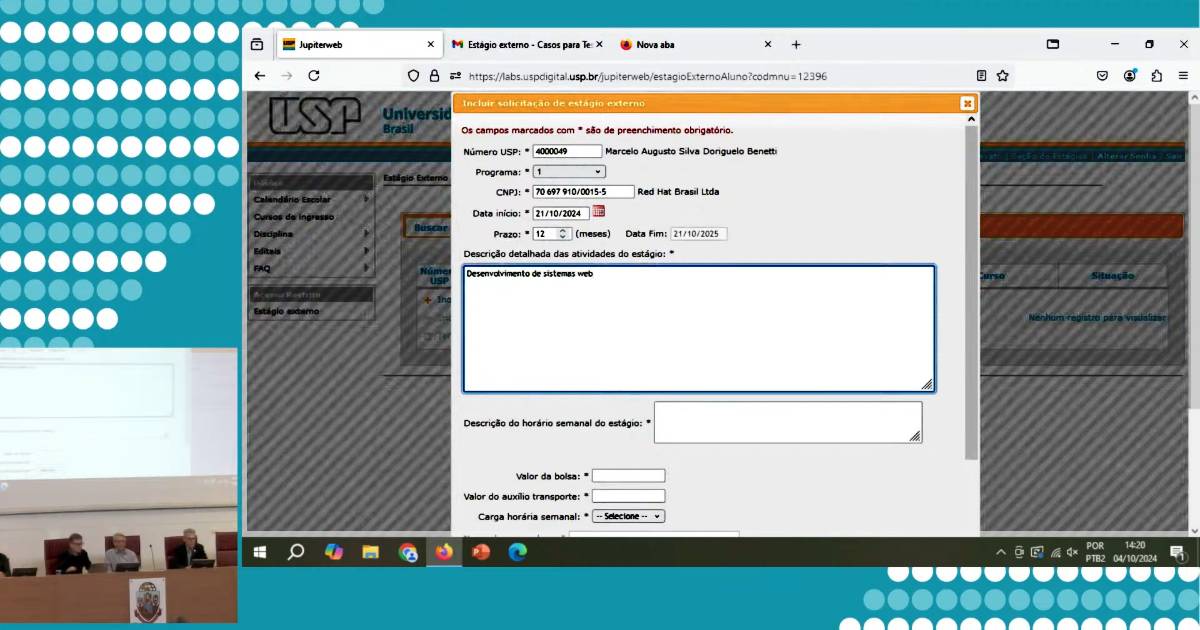
Representação tridimensional da proteína GPCR, vista do alto (a esquerda) e lateralmente (a direita), responsável por receber e transmitir às células sinais vindos do meio exterior que influenciam em seu funcionamento - Imagem: Bensaccount via Wikimedia Commons / Dominio público
Um estudo internacional com a participação de pesquisadores da USP trouxe novas informações sobre uma proteína de grande interesse para a produção de medicamentos. Os cientistas conseguiram determinar com precisão a estrutura de uma parte da proteína conhecida como GPCR, que faz a sinalização entre o interior da célula e o meio externo, sendo essencial para que os fármacos façam efeito no organismo. A descoberta contribuirá para o desenvolvimento de novos medicamentos com a GPCR, que já é utilizada em 30% dos fármacos comercializados nos Estados Unidos.

Enzima que protege o parasita causador da doença de Chagas pode ser alvo para novos tratamentos
Pesquisadores descobriram que a enzima P5CR faz parte de um mecanismo importante para a sobrevivência do parasita Trypanosoma cruzi
O estudo é descrito em artigo publicado na revista Science Advances, em 14 de agosto. “As células do corpo humano são envoltas por uma barreira física, a membrana plasmática. Nessa membrana existem várias proteínas que fazem a comunicação do que está dentro com o que está fora da célula, entre elas as GPCR”, conta ao Jornal da USP o professor Antônio José da Costa Filho, da Faculdade de Filosofia, Ciências e Letras e Ribeirão Preto (FFCLRP) da USP, que participou da pesquisa. “Elas são proteínas grandes e cada uma tem uma parte apontada para dentro da célula e parte para fora. A parte que fica do lado de fora funciona como uma espécie de sensor, recebendo sinais extracelulares que fazem a célula entrar em atividade.”
Existem várias famílias de GPCR, com diversas funções, como detectar hormônios, moléculas que são sensíveis a luz e neurotransmissores. “No estudo foi analisado um tipo de proteína que se liga a um neurotransmissor, que é a neurotensina”, explica o professor. “Quando a neurotensina chega ao lado de fora da célula, o receptor se liga a ela, fazendo com que a proteína mude sua estrutura e disparando uma série de vias de sinalização que vão apontar a célula qual resposta deve ser dada ao mundo exterior.”

Pesquisadores descobrem complexo proteico azul que faz sapos ficarem verdes
Estudo com colaboração da USP descreveu como algumas espécies do anfíbio conseguem estabilizar uma substância tóxica para se camuflarem nas folhas
Lipoproteínas produzidas em laboratório reduzem efeito tóxico da quimioterapia
Técnica desenvolvida em laboratório da USP está sendo testada também em outras áreas, como cardiologia e transplante de órgãos
De acordo com o professor da FFCLRP, cerca de 30% dos fármacos aprovados pelo FDA (órgão do governo dos Estados Unidos responsável pela vigilância de alimentos e medicamentos) têm como alvo algum tipo de GPCR. “Se você quer fazer a célula desempenhar alguma função, ou desligar algo, uma boa maneira é arrumar um modo de fazer com que essas moléculas que carregam informação do lado de fora liguem ou desliguem a célula”, aponta. “Por isso a indústria farmacêutica tem interesse em estudar essas famílias de proteínas.”
A pesquisa se concentrou em uma parte da proteína que fica no interior das células, a hélice 8. “A ideia é obter mais informações de como se organiza essa parte, e quais são as mudanças que acontecem quando a proteína faz uma ligação. Por serem proteínas grandes e de membrana, as GPCR são de difícil preparação para estudos experimentais em geral, dentre eles aqueles que visam a determinação de sua estrutura tridimensional com métodos de biologia estrutural”, afirma Silva Filho. “Em geral, os cientistas fazem mutações na proteína ou agregam outras moléculas para tornar a estrutura mais estável e permitir as análises.”
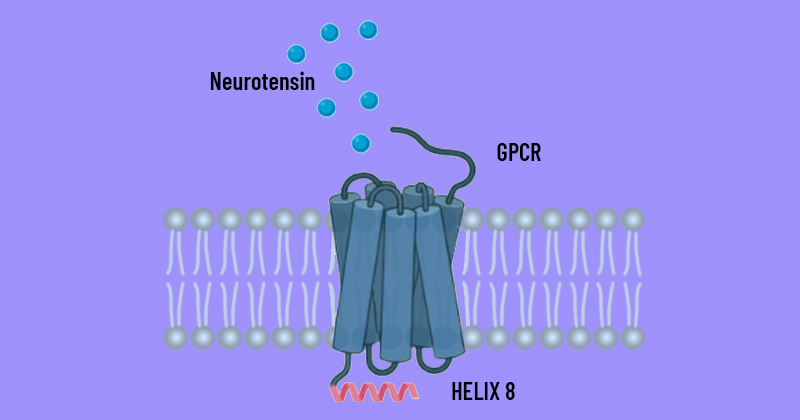
Representação gráfica de proteína do tipo GPCR; situada na membrana celular, transmite sinais do neurotransmissor neurotensina para o interior da célula, onde fica a hélice 8, cuja estrutura foi detalhada na pesquisa - Imagem: Cedida pelo pesquisador
O grupo de pesquisadores queria trabalhar com uma proteína cuja estrutura fosse a mais próxima possível de seu estado natural, sem alterações. “Foi criado um protocolo para produzir a estrutura inteira do receptor de neurotensina, dispensando as modificações químicas”, destaca o professor. “Isso foi necessário porque nas proteínas modificadas a hélice 8 não aparece ou apresenta uma informação ambígua sobre sua estrutura.”

Professor Antônio José da Costa Filho: descobertas podem ajudar no planejamento de medicamentos - Foto: Divulgação-IEA
Por meio de métodos biofísicos (ressonância paramagnética eletrônica, uma técnica que utiliza micro-ondas para analisar a estrutura de materiais, e dicroísmo circular) e de simulações computações de dinâmica molecular, os cientistas conseguiram determinar com precisão a estrutura da hélice 8. “O estudo verificou que quando uma molécula que imita a neurotensina é colocada em contato com a proteína, essa hélice fica ainda mais estruturada”, diz Costa Filho ao Jornal da USP. “Também foi descoberto que a estruturação da hélice 8 é influenciada pelas moléculas de gordura (fosfolipídeos) existentes na membrana celular. Anteriormente se imaginava que essas moléculas simplesmente formavam uma barreira física.”
Segundo o professor da FFCLRP, o estudo contribuiu com informações sobre uma parte menos conhecida de uma proteína de grande interesse farmacológico.
Apesar de ser um trabalho de ciência básica, ele abre a possibilidade de que outros grupos de cientistas, que estudam planejamento de medicamentos, possam usar a hélice 8 como alvo farmacológico”, ressalta.
A pesquisa é descrita no artigo Conformational dynamics of a G protein–coupled receptor helix 8 in lipid membranes, publicado em 14 de agosto na revista Science Advances.
A pesquisa com a GPCR foi coordenada pelo professor Anthony Watts, da Universidade de Oxford (Reino Unido). Uma doutoranda do Instituto de Física de São Carlos (IFSC), Patrícia Kumagai, orientada pelo professor Costa Filho, fez um estágio-sanduíche em Oxford, e depois se juntou ao projeto. Os pesquisadores da FFCLRP contribuíram com os experimentos de ressonância paramagnética eletrônica. Atualmente, Patrícia faz parte da equipe técnica da empresa de biotecnologia sediada em Valinhos (interior de São Paulo).
Mais informações: e-mail ajcosta@usp.br, com o professor Antônio José da Costa Filho
A reprodução de matérias e fotografias é livre mediante a citação do Jornal da USP e do autor. No caso dos arquivos de áudio, deverão constar dos créditos a Rádio USP e, em sendo explicitados, os autores. Para uso de arquivos de vídeo, esses créditos deverão mencionar a TV USP e, caso estejam explicitados, os autores. Fotos devem ser creditadas como USP Imagens e o nome do fotógrafo.