Blog
Fragmentos tóxicos de proteínas no cérebro podem ser marcadores de Alzheimer em vida
Biomarcador ajudaria no monitoramento da doença de Alzheimer, para a qual não há um marcador único que possa fornecer um diagnóstico definitivo em vida
Estudos sobre a presença da proteína tau na forma dividida no líquido cefalorraquidiano e no soro do cérebro ainda são limitados, mas as descobertas que surgem mostram-se promissoras - Foto: Kipargeter/Freepik- Foto: Kipargeter/Freepik
Tauopatias são doenças neurodegenerativas associadas a depósitos anormais de uma proteína chamada tau no cérebro, com alta mortalidade e sem cura. O tipo mais comum de tauopatia é a doença de Alzheimer e, atualmente, não há um biomarcador que identifique a doença com precisão no paciente em vida. O diagnóstico é feito em entrevista com o paciente, avaliação neuropsicológica e por exclusão de outras doenças em exames de sangue e imagem.
Trabalho de cientistas da USP e da Universidade da Califórnia em São Francisco (UCSF), nos Estados Unidos, avalia o uso de fragmentos da proteína nos líquidos cerebrais como biomarcador para diagnóstico em vida e monitoramento de Alzheimer e doenças similares.
Os resultados do trabalho são relatados em artigo publicado pela revista científica Acta Neuropathologica Communications. “A doença de Alzheimer afeta milhões de pessoas no mundo, entretanto, existem outras tauopatias mais raras, incluindo a encefalopatia traumática crônica que afeta atletas e a paralisia supranuclear progressiva”, afirmam Lea Grinberg, professora da UCSF e da Faculdade de Medicina da USP (FMUSP), e Liara Rizzi, pós-doutoranda da Unicamp, autoras do artigo.

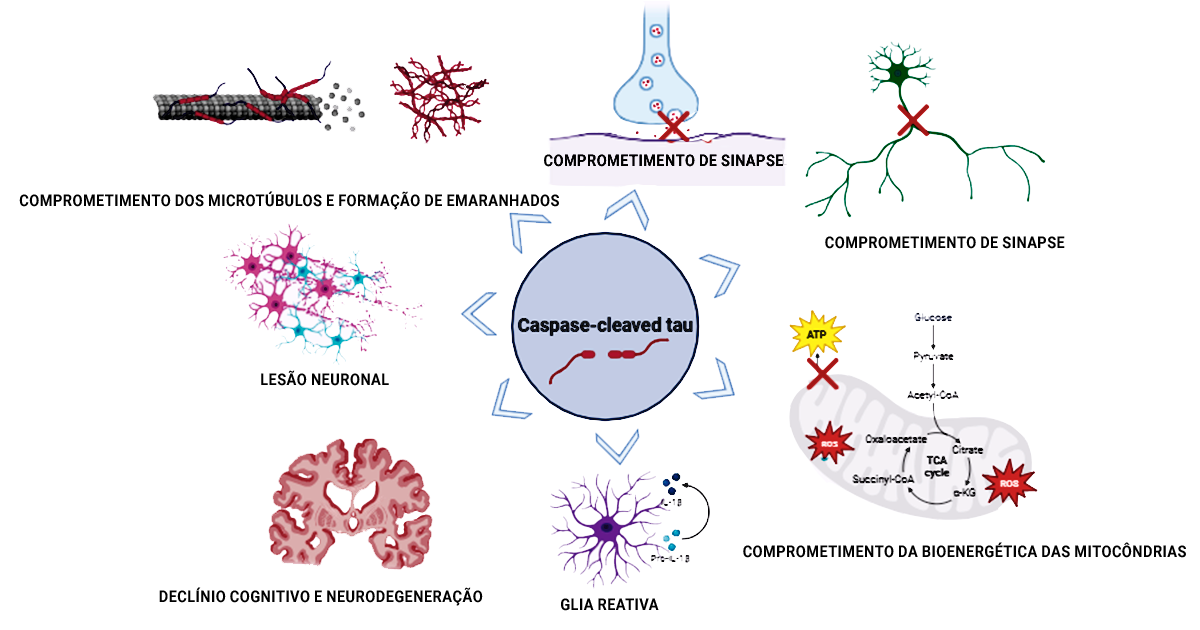
“Um estudo prévio feito pelo nosso grupo de pesquisa identificou no tecido cerebral humano após a morte que o número de neurônios que acumulam tau clivada por caspase, que é neurotóxica, é similar ao número de neurônios que acumulam tau fosforilada, ou fosfo-tau, a alteração mais estudada em doenças neurodegenerativas”, relatam as pesquisadoras. As caspases são um grupo de proteases, enzimas que dividem proteínas, comumente associadas a inflamação e morte celular (apoptose), e que participam da quebra da proteína tau (proteólise).
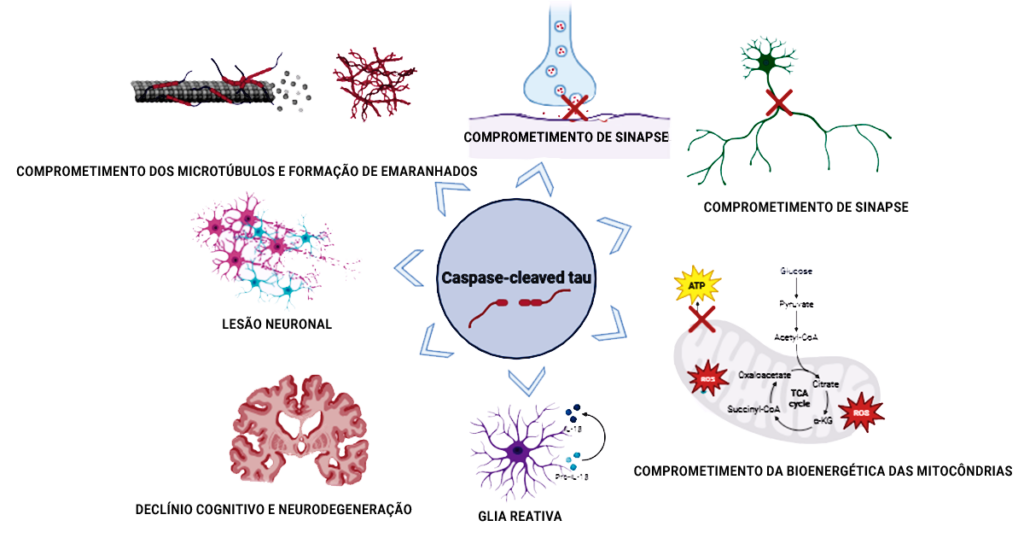
“A proteína tau pode sofrer clivagem por várias caspases, incluindo as dos tipos 1, 2, 3, 6, 7 e 8, no entanto, a sobreposição é de apenas 45%”, apontam Lea Grinberg e Liara Rizzi. “Isso sugere que estudos baseados somente em fosfo-tau não identificam completamente a patologia da proteína tau e que, em casos de divisão pelas caspases, ela é parcialmente distinta e complementar a da fosfo-tau”.
Diagnóstico em vida
De acordo com as cientistas, estudos sobre formas de tau divididas pelas caspases no líquido cefalorraquidiano e no soro do cérebro são limitados, mas as descobertas emergentes mostram-se promissoras, sublinhando a necessidade de uma exploração mais profunda. “Essas pesquisas mostram que a detecção de fragmentos neurotóxicos de tau oferecem uma oportunidade para diagnóstico in vivo e monitoramento de doenças neurodegenerativas”, ressaltam.

“Dessa forma, dada a abundância de tau dividida pela caspase-6 na doença de Alzheimer e a escassez em tauopatias 4R, como a paralisia supranuclear progressiva, vale a pena testar se um ensaio com esse tipo de tau tem melhor desempenho na sua identificação do que os baseados em fosfo-tau”, apontam Lea Grinberg e Liara Rizzi. “Provavelmente, a aplicação mais pertinente é a identificação de patologia não associada a fosfo-tau na doença de Alzheimer.”
As pesquisadoras acrescentam que a detecção de tau dividida por caspase in vivo pode ser extremamente significativa tanto para fins diagnósticos quanto terapêuticos. “Nosso grupo desenvolveu um ensaio químico para detecção de tau truncada por caspase no líquor do cérebro, que agora está em testes com amostras clínicas.”
O estudo contou também com a participação dos pesquisadores Lea Julio, Rojas-Martinez e Michelle Arkin, do Memory and Aging Center da Universidade da Califórnia em São Francisco (UCSF). A primeira autora do artigo é Liara Rizzi, pós-doutoranda da Unicamp, que teve parte de sua bolsa para fazer pesquisas na UCSF financiada pela Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp).
Mais informações: e-mails lea.grinberg@ucsf.edu, com Lea Grinberg, e Liara.Rizzi@ucsf.edu, com Liara Rizzi
A reprodução de matérias e fotografias é livre mediante a citação do Jornal da USP e do autor. No caso dos arquivos de áudio, deverão constar dos créditos a Rádio USP e, em sendo explicitados, os autores. Para uso de arquivos de vídeo, esses créditos deverão mencionar a TV USP e, caso estejam explicitados, os autores. Fotos devem ser creditadas como USP Imagens e o nome do fotógrafo.
 Lenda da imagem principal: Detecção de proteína em pacientes vivos pode ser extremamente significativa tanto para fins diagnósticos quanto terapêuticos
Tauopatias são doenças neurodegenerativas associadas a depósitos anormais de uma proteína chamada tau no cérebro, com alta mortalidade e sem cura. O tipo mais comum de tauopatia é a doença de Alzheimer, cujo diagnóstico definitivo atualmente depende de autópsia, já que análise só pode ser feita após a morte do paciente. Em artigo de revisão, cientistas da USP e da Universidade da Califórnia em São Francisco (UCSF), nos Estados Unidos, avaliam o uso de fragmentos da proteína nos líquidos cerebrais como biomarcador para diagnóstico em vida e monitoramento de Alzheimer e doenças similares.
Os resultados do trabalho são relatados em artigo publicado no último pela revista científica Acta Neuropathologica Communications. “A doença de Alzheimer afeta milhões de pessoas no mundo, entretanto, existem outras tauopatias mais raras, incluindo a encefalopatia traumática crônica que afeta atletas, e a paralisia supranuclear progressiva”, afirmam Lea Grinberg, professora da UCSF e da Faculdade de Medicina da USP, e Liara Rizzi, pós-doutoranda da Unicamp, autoras do artigo.
Lenda da imagem principal: Detecção de proteína em pacientes vivos pode ser extremamente significativa tanto para fins diagnósticos quanto terapêuticos
Tauopatias são doenças neurodegenerativas associadas a depósitos anormais de uma proteína chamada tau no cérebro, com alta mortalidade e sem cura. O tipo mais comum de tauopatia é a doença de Alzheimer, cujo diagnóstico definitivo atualmente depende de autópsia, já que análise só pode ser feita após a morte do paciente. Em artigo de revisão, cientistas da USP e da Universidade da Califórnia em São Francisco (UCSF), nos Estados Unidos, avaliam o uso de fragmentos da proteína nos líquidos cerebrais como biomarcador para diagnóstico em vida e monitoramento de Alzheimer e doenças similares.
Os resultados do trabalho são relatados em artigo publicado no último pela revista científica Acta Neuropathologica Communications. “A doença de Alzheimer afeta milhões de pessoas no mundo, entretanto, existem outras tauopatias mais raras, incluindo a encefalopatia traumática crônica que afeta atletas, e a paralisia supranuclear progressiva”, afirmam Lea Grinberg, professora da UCSF e da Faculdade de Medicina da USP, e Liara Rizzi, pós-doutoranda da Unicamp, autoras do artigo.