
Blog

Foto: Marcos Santos / USP Imagens
USP ajuda a conceber projeto para rastrear medicamentos no Brasil
Poli, Hospital das Clínicas, Anvisa e PNUD criaram o projeto que vai ajudar a trazer mais segurança ao setor
Pesquisadores da USP participam do grupo que concebeu o projeto para implantar o rastreamento de medicamentos no Brasil. O objetivo é inibir roubos e falsificações, trazendo mais segurança aos consumidores e indústria. A parceria envolve o Grupo de Automação Elétrica em Sistemas Industriais (Gaesi) da Escola Politécnica (Poli) da USP, o Núcleo de Inovação do Hospital das Clínicas da Faculdade de Medicina da USP (FMUSP), a Agência Nacional de Vigilância Sanitária (Anvisa) e o Programa das Nações Unidas para o Desenvolvimento (PNUD). A iniciativa resultou em um projeto piloto que está sendo testado por empresas farmacêuticas, distribuidoras de medicamentos, hospitais e drogarias. A implantação tem previsão de ser finalizada no País até 2022.
O projeto vem atender à Lei Federal nº 13.410/16, de 2016, que determina a criação do Sistema Nacional de Controle de Medicamentos, visando ao controle da produção, distribuição e comercialização de medicamentos no Brasil.

O engenheiro Vidal Augusto Zapparoli Castro Melo, do Gaesi, é um dos integrantes do projeto – Foto: Leonor Calasans via IEA / USP
“O grande objetivo é inibir furtos e falsificação que atingem o setor”, conta o engenheiro Vidal Augusto Zapparoli Castro Melo, do Gaesi. “Estudos mencionam que em países desenvolvidos, a estimativa é que até 5% dos medicamentos sejam alvo de furtos e falsificações. Em países em desenvolvimento, esse porcentual pode chegar até 20% ou 30%”, diz.
Data matrix
A rastreabilidade vai funcionar a partir da criação de um número único, no momento da fabricação do medicamento, que será codificado e colocado na caixa na forma de um Data Matrix, código de barras bidimensional muito semelhante visualmente ao QRCode, que vai conter número de série, lote, validade, número de registro na Anvisa e código GTIN (sigla em inglês para Global Trade Identification Number, que é o código comercial do produto). Se o produto for importado, o importador ficará responsável pela serialização e impressão do Data Matrix.
“É um processo na linha de produção. A indústria precisará implantar equipamentos e sistemas específicos que façam essa geração e impressão dos dados nas embalagens de medicamentos”, explica Melo.
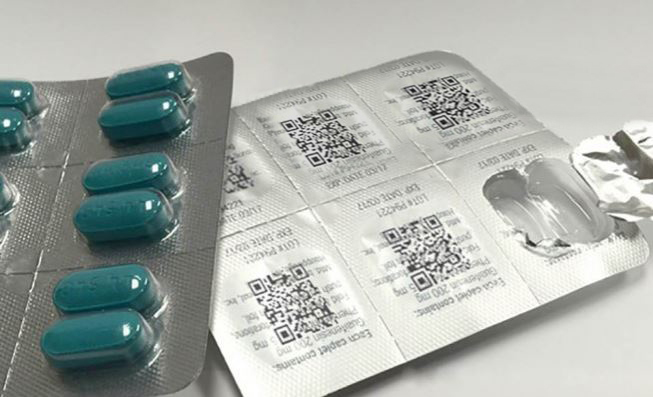
O Data Matrix vai estar impresso na embalagem dos medicamentos – Foto: divulgação
De acordo com o pesquisador, após todas as etapas de controle de qualidade da indústria, esse número único vai ser comunicado para a Anvisa ter ciência de que aquela unidade será comercializada no mercado nacional.
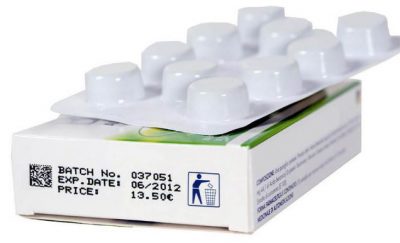
O Data Matrix vai conter o número de série, lote, validade, número de registro na Anvisa e o código comercial do produto – Foto: divulgação
A partir daí, todas as etapas seguintes serão rastreadas e obrigatoriamente deverão ser comunicadas à Anvisa, desde a saída da fábrica, a entrega para os distribuidores e até a venda final ao consumidor (ou do uso em hospitais). Quando isso ocorrer, o último elo (farmácias ou hospitais) deverá informar à agência da finalização do rastreamento e que aquela caixa deixou de fazer parte da cadeia de medicamentos do Brasil. “Para o futuro, está previsto que o consumidor final tenha um aplicativo de celular e possa consultar a rastreabilidade dos medicamentos”, conta Vidal Melo.
A concepção do projeto foi realizada por integrantes do Gaesi, do Hospital das Clínicas e da Anvisa. O Gaesi desenvolveu um ambiente on-line onde foram realizados os primeiros testes, tendo como base a rotina do Hospital das Clínicas. Essa etapa durou o período de agosto de 2018 até março de 2019.
Projeto piloto

Grupo da Poli cria projetos de automação para governos e empresas
Sistemas do GAESI impactam áreas de comércio exterior, mobilidade urbana e fiscalização antifraude, conta coordenador

Sistema otimiza fiscalização de carga agropecuária para exportação
Desenvolvido na USP, sistema será adotado pelo Ministério da Agricultura a partir de abril para produtos de origem animal
O passo seguinte foi implantar o projeto piloto. Os testes começaram em março de 2019 e tiveram a participação das empresas Ache Laboratórios Farmacêuticos, Bayer Schering, Biosintética Farmacêutica, Boehringer Ingelheim, Drogaria Araujo, Drogaria Soares, Fundação São Francisco Xavier, Genésio A Mendes & Cia, Hospital Albert Einstein, Janssen Manufacturing, Libbs Farmacêutica, Profarma Specialty, Raia Drogasil, S.M. Mantovani e Cia., além de diversas empresas de tecnologia interessadas no setor. Esses primeiros testes foram realizados até o final do último mês de abril, quando a Anvisa publicou um relatório com as primeiras considerações sobre o projeto piloto.
Os testes vão continuar pelos próximos anos até que todos os ajustes sejam feitos e a implantação possa ser finalizada. Segundo a Lei 13.410, a Anvisa deve começar a implantar o projeto em território nacional até 28 de abril de 2022, período em que o setor terá de se adaptar às novas regras com base em um cronograma a ser definido.
Os trabalhos tiveram a coordenação do professor Eduardo Mario Dias, da Escola Politécnica (Poli) da USP. Além de Vidal Augusto Zapparoli Castro Melo, também participaram do projeto os pesquisadores Alinne Beteto, Anderson Eleutério, Eduardo Almeida, Leonardo Eloi Mathias, Antonio Joaquim de Souza Meneses, Aécio Meneses Alves e José Antonio Tosta.
Ouça a entrevista que o professor Eduardo Mario Dias e o pesquisador Vidal Melo concederam ao Podcast Momento Tecnologia#10 sobre este projeto.
Mais informações: e-mail gaesi@pea.usp.br, no Grupo de Automação Elétrica em Sistemas Industriais (Gaesi) da Escola Politécnica da USP
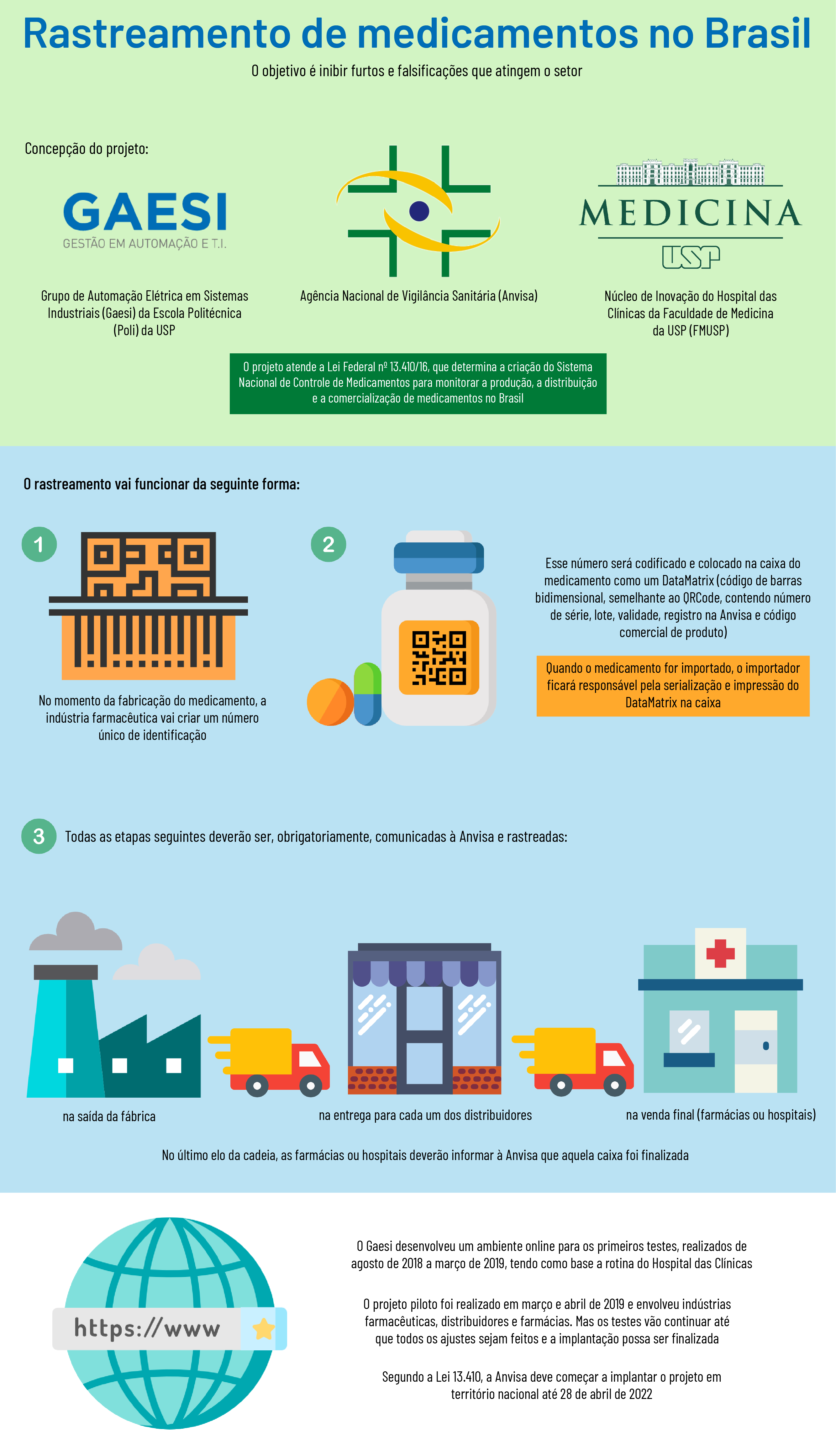
Infografia: Beatriz Abdalla / Jornal da USP



































