
Blog
Coronavírus no cérebro:
Drogas que bloqueiam receptor poderiam prevenir ou tratar problemas neurológicos
Grupo propõe que invasão do coronavírus no Sistema Nervoso Central envolve a ativação do receptor P2X7 e que, portanto, medicamentos que o bloqueiam podem ser estratégia promissora
Reportagem: Luiza Caires
Diagramação: Camila Paim
Sintomas neurológicos têm sido relatados em pacientes com covid-19 e crescem as evidências de que o coronavírus tem a capacidade de neuroinvasão, ou seja, de entrar no sistema nervoso central e infectar suas células. Um artigo de pesquisadores da USP e colaboradores no periódico Molecular Psychiatry discute possíveis mecanismos para que os vírus acessem o sistema nervoso e os efeitos inflamatórios que provocam no cérebro, sugerindo que a ativação exagerada de um receptor celular chamado P2X7R está associada a essa “tempestade inflamatória”.
Coordenador da pesquisa, o professor do Instituto de Química (IQ) da USP Henning Ulrich explica que a infecção por sars-cov-2 induz a uma condição de neuroinflamação, e que “a inflamação crônica no cérebro é uma característica em doenças psiquiátricas como depressão e também neurodegenerativas, como a doença de Parkinson”.

Deste modo, os pacientes com estes distúrbios, que estão associados à ativação de mecanismos neuroimunes, podem ser mais suscetíveis a desenvolver condições graves do sistema nervoso central pela covid-19. Drogas para diminuir esta ativação, portanto, poderiam ser um caminho para evitar os danos da doença no cérebro.
O cérebro está logo ali
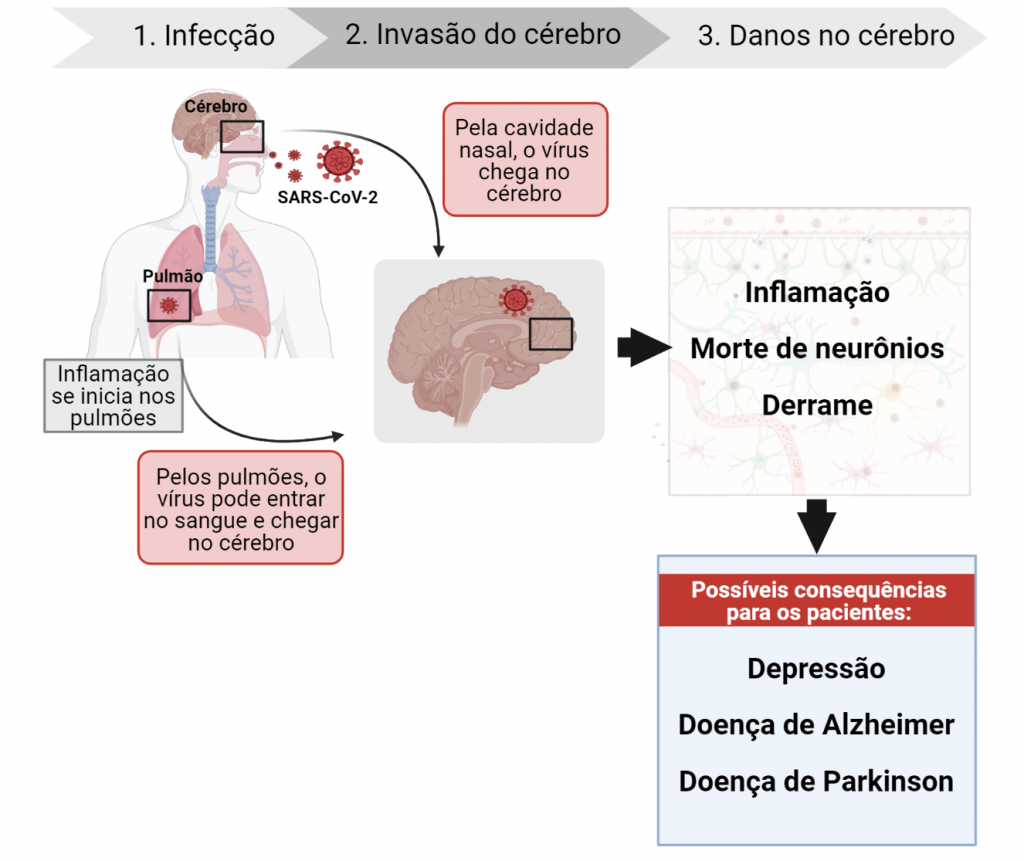
A primeira pergunta que podemos fazer é: como o coronavírus chega até o cérebro?. Este é um processo intrincado para ser descrito, mas que na prática pode ocorrer relativamente rápido.


“Estudos após a morte indicam que o vírus é capaz de infectar células do cérebro, uma vez que ele já foi identificado no tecido cerebral de pacientes infectados com o sars-cov-2”, diz Deidiane Elisa Ribeiro, que realiza pós-doutorado no IQ e que divide a primeira autoria do trabalho com a também pesquisadora em pós-doutorado Ágatha Oliveira Giacomelli. Ela explica que, para isso, o vírus precisa ultrapassar uma proteção que envolve nosso encéfalo chamada barreira hematoencefálica, e há algumas hipóteses sobre como ele consegue fazer isso.
Ícones: Studio Gstock/ Freepik
Para começar, o vírus entra no corpo principalmente pelo nariz, e chega até os pulmões. E para infectar qualquer célula, ele precisa se ligar a proteínas que ficam nas membranas das células, chamadas receptores. Mas é necessário que sejam os receptores certos. Nos pulmões, ele utiliza tanto receptores TMPRSS2 como ACE2.

Após infectar algumas células do pulmão, e se reproduzir usando a maquinaria celular (já que o vírus não possui uma), o sars-cov-2 se espalha pelo órgão rapidamente. As células que foram infectadas liberam proteínas pró-inflamatórias e moléculas de ATP (aquela molécula mais conhecida por ser a reserva de energia nas células). Quando está em grande quantidade no meio externo à célula, o ATP causa danos celulares.
O ATP também ativa receptores P2X7 em células pulmonares e em macrófagos – células de defesa que fagocitam (englobam e destroem) agentes estranhos como vírus. Isso faz com que os macrófagos aumentem a liberação das principais substâncias do processo inflamatório, as citocinas, além de quimiocinas – e mais ATP, num ciclo que se retroalimenta induzindo à famosa “tempestade de citocinas”. Vários processos fisiológicos ficam desregulados em razão disso.
Pela circulação, tanto o vírus como os fatores pró-inflamatórios liberados chegam a outros tecidos do corpo, inclusive ao cérebro. Para isso, ele infecta as células endoteliais da barreira hematoencefálica, além de infectar astrócitos e neurônios adjacentes aos vasos sanguíneos ligando-se aos receptores ACE2 destas células.
Durante a infecção, a barreira hematoencefálica fica mais permeável e deixa que passem para o tecido cerebral citocinas (moléculas pró-inflamatórias) e células de defesas como leucócitos. O problema é que muitos desses leucócitos estão infectados, recheados de vírus, e agem como cavalos de tróia, levando os vírus para dentro do sistema nervoso central. Está aí uma das rotas do sars-cov-2 até o cérebro, mas há outra possível, que também começa no nariz.
Na cavidade nasal, o vírus infecta e se multiplica em células sustentaculares, usando como acesso, novamente, os receptores TMPRSS2 e ACE2. Essas células também expressam os receptores P2X7 e iniciam um ciclo semelhante ao já descrito.
Finalmente, o sars-cov-2 também pode infectar neurônios sensoriais olfativos, e usar suas conexões para ingressar no sistema nervoso central.
Uma vez no cérebro, o vírus pode alterar funções cerebrais tanto infectando neurônios e células da glia (outras células do sistema nervoso que têm uma série de funções), quanto pelos efeitos que vêm da tempestade de citocinas. O resultado é um processo inflamatório caracterizado por hiperativação das células da glia. Ainda, a tempestade de citocinas induz à formação de coágulos e aumenta a permeabilidade de pequenos vasos sanguíneos, os capilares, podendo resultar em um acidente vascular cerebral, o AVC.
A importância do receptor P2X7
Na fisiologia humana, alguns estímulos podem levar a um ciclo que reforça o desequilíbrio. Ciclos assim são chamados de feedback positivo, ou retroalimentação positiva. O mecanismo envolvido nos prejuízos causados pelo coronavírus no tecido cerebral pode ser caracterizado como um feedback positivo, desencadeando uma série de eventos danosos que se intensificam mutuamente.
Primeiramente, o estresse celular induz à liberação daquelas substâncias pró-inflamatórias, as citocinas, e do ATP. O ATP, por sua vez, ativa os receptores P2X7, que no cérebro estão presentes principalmente em células da glia. A primeira é a micróglia, que no sistema nervoso central tem, entre outros papéis, a função de defesa. Outro tipo de células da glia que têm receptores P2X7 são os astrócitos. Com os receptores P2X7 ativados, aumenta a entrada de cálcio nestas células, o que, por sua vez, aumenta a liberação de um neurotransmissor chamado glutamato. O glutamato ativa outros receptores presentes nos astrócitos e nos terminais nervosos dos neurônios – o que também abre as portas para entrada de cálcio nessas células, resultando, de novo, em liberação de glutamato e de mais ATP. “O ATP foi sugerido há pouco tempo como um neurotransmissor”, lembra Deidiane Ribeiro, “então esta é uma proposta relativamente recente, e tem se mostrado que este sistema tem várias funções em diversas patologias”.
A partir daí, o cálcio que ingressa nos neurônios desencadeia outros mecanismos que resultam na produção de óxido nítrico, entrando em reações que, por sua vez, geram as chamadas espécies reativas de oxigênio, mais conhecidas como radicais livres, extremamente danosos às células, desde as membranas celulares até o próprio DNA. “O principal efeito disso seria a morte de neurônios”, explica Deidiane Ribeiro.
Conforme o cálcio entra na célula pela ativação do receptor P2X7, o potássio sai dela. Nas micróglias, esse potássio pode desencadear a ativação de um inflamassoma (complexo de proteínas que é um sensor da inflamação) chamado NLRP3. “O inflamassoma é uma espécie de sensor de perigo”, define o professor Ulrich. O NLRP3 então induz a uma cascata de eventos que, ao final, resulta no agravamento do processo inflamatório.
A hiperativação do receptor P2X7 e a estimulação do inflamassoma NLRP3 são observadas em pacientes com desordens psiquiátricas e doenças neurodegenerativas, como o Parkinson. Isso, postulam os pesquisadores, poderia aumentar tanto a suscetibilidade destes pacientes à infecção pelo sars-cov-2 quanto a gravidade com que a covid-19 se manifesta neles. Além disso, a infecção pelo sars-cov-2 em si poderia desencadear ou agravar esses transtornos cerebrais.
Assim, argumentam, inibir a expressão exagerada do receptor P2X7 e também do inflamassoma NLRP3 poderiam ser estratégias promissoras para prevenir ou tratar complicações psiquiátricas ou doenças neurodegenerativas associadas à covid-19.
Alto impacto
O professor Henning Ulrich destaca o reconhecimento do trabalho dos pesquisadores, publicado numa revista científica de alto impacto pertencente ao grupo Nature. “Temos poucos trabalhos brasileiros nesta revista, que também cobra uma taxa de mais de 4 mil dólares para que os artigos fiquem disponíveis em acesso aberto. Devido à importância do nosso trabalho, reconhecida pelos editores, foi permitido que o artigo ficasse aberto sem que fosse cobrada esta taxa”, conta, ao ressaltar que este é o segundo artigo do seu grupo publicado no periódico desde o último ano.
Ulrich é o principal nome no Brasil na pesquisa de doenças psiquiátricas e neurodegenerativas e mecanismos de neurorregeneração envolvendo a chamada sinalização purinérgica, descoberta nos anos 1990, e de que participam os receptores purinérgicos, especialmente o P2X7, ativado pelo ATP.
“O que investigamos é o efeito danoso deste receptor na doença de Parkinson, em que estamos vendo características similares ao que estamos propondo aqui para a covid, como a morte celular”, diz. E completa: “quando inibimos o receptor P2X7 em modelos animais, vemos tanto uma melhoria na função motora, afetada no Parkinson, como uma redução da morte neuronal, especificamente dos neurônios dopaminérgicos, envolvidos nesta doença, além de uma diminuição da neuroinflamação, com a redução da ativação excessiva da glia, que é muito danosa no sistema nervoso”.
Henning Ulrich
O artigo Hyperactivation of P2X7 receptors as a culprit of COVID-19 neuropathology tem autoria de Deidiane Elisa Ribeiro (IQ) e Ágatha Oliveira-Giacomelli (IQ), com colaboração de Talita Glaser (IQ), Vanessa F. Arnaud-Sampaio (IQ), Roberta Andrejew (IQ), Luiz Dieckmann (Unifesp), Juliana Baranova (IQ), além da professora do IQ Claudiana Lameu, do professor Mariusz Z. Ratajczak (Universidade de Louisville, EUA) e do professor do IQ Henning Ulrich, que é o coordenador das pesquisas.



































