No artigo, ainda não revisado por pares, os autores descrevem como o contato com o novo coronavírus altera o funcionamento do macrófago – uma espécie de “gari” do sistema imune encarregado de eliminar restos de células mortas e outras partículas estranhas ao organismo – Fotomontagem sobre imagens Freepik
Sars-cov-2 inibe remoção de células mortas pelo sistema imune, favorecendo o dano pulmonar
A pesquisa da Faculdade de Medicina de Ribeirão Preto esclarece o desequilíbrio no sistema de defesa que leva ao agravamento da covid-19
25/03/2021
Por Karina Toledo | Agência Fapesp
Arte: Camila Paim/Jornal da USP
Já é praticamente consenso entre os cientistas que o agravamento da covid-19 está relacionado com um desequilíbrio na resposta imune ao sars-cov-2. No entanto, ainda não se sabe exatamente quais componentes do sistema de defesa estão atuando de forma desregulada nesses casos e por que isso acontece. Em estudo divulgado na plataforma meRxiv, pesquisadores da USP sugerem respostas para uma parte do quebra-cabeça.
No artigo, ainda não revisado por pares, os autores descrevem como o contato com o novo coronavírus altera o funcionamento do macrófago – uma espécie de “gari” do sistema imune encarregado de eliminar, por meio da fagocitose, restos de células mortas e outras partículas estranhas ao organismo.
Por meio de experimentos in vitro, os cientistas descobriram que, ao internalizar uma célula infectada pelo sars-cov-2 ainda ativo, o macrófago passa a produzir quantidades excessivas de moléculas pró-inflamatórias, o que pode contribuir para o quadro conhecido como tempestade de citocinas, observado em pacientes com a forma grave da doença. Além disso, de acordo com o estudo, a internalização de uma célula morta infectada reduz em até 12 vezes a capacidade do macrófago de reconhecer e fagocitar outras células mortas que eventualmente surgirem em seu caminho.
“Milhões de células morrem em nosso organismo todos os dias e elas precisam ser eliminadas de forma eficiente. Caso contrário, poderiam ser interpretadas como um sinal de perigo ou gerar autoantígenos, favorecendo o surgimento de doenças autoimunes. No caso do pulmão afetado pelo sars-cov-2, a remoção contínua das células mortas pelos macrófagos é essencial para a regeneração do tecido. Se a presença do vírus em uma célula fagocitada subverte essa função dos macrófagos, possivelmente contribui para o dano tecidual extenso característico da covid-19”,
diz Larissa Cunha, professora da Faculdade de Medicina de Ribeirão Preto (FMRP) da USP e coordenadora da pesquisa, que contou com financiamento da Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp).

Larissa Dias da Cunha – Foto: FMRP-USP
Evidências preliminares
Os primeiros testes descritos no artigo foram feitos com duas linhagens de células epiteliais – uma originária de pulmão humano (Calu-3) e outra de rim de macaco (Vero CCL81, um dos principais modelos para estudo do sars-cov-2) –, que foram infectadas in vitro com o novo coronavírus. Os pesquisadores observaram que a infecção ativa na célula epitelial um processo conhecido como apoptose – um tipo de morte celular programada que, normalmente, não desperta uma resposta inflamatória no organismo.
Paralelamente, em outro conjunto de células epiteliais, os pesquisadores induziram a apoptose por meio de radiação ultravioleta.
As células apoptóticas de ambos os grupos (infectadas com o coronavírus e expostas à radiação) foram coletadas e colocadas para interagir com culturas de macrófagos derivados de monócitos humanos (um dos tipos de leucócitos do sangue).
Como esperado, ao internalizar as células mortas pela radiação, os macrófagos assumiam um fenótipo anti-inflamatório, que favorece a reparação do tecido lesado. Já quando fagocitavam as células que continham o sars-cov-2 ainda viável (capaz de infectar outra célula) essa programação se perdia e os macrófagos passavam a secretar altas quantidades de moléculas pró-inflamatórias, como a interleucina 6 (IL-6) e a interleucina 1 beta (IL-1β).
“Nossos resultados fornecem evidências de que o englobamento de células moribundas que carregam o sars-cov-2 viável muda a programação anti-inflamatória e resolutiva [da inflamação] em direção a um fenótipo inflamatório. A exacerbada produção de citocinas observada em resposta à internalização de células mortas infectadas pode contribuir para a hiperinflamação associada à covid-19”,
afirmam os autores no artigo.
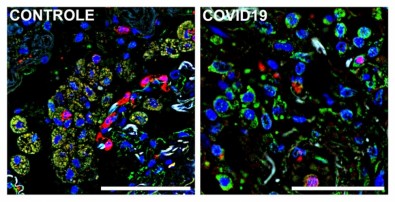
Imagens de imunofluorescência de tecido pulmonar obtido por meio de autópsia — à direita, paciente que morreu por complicações da covid-19 e à esquerda, de falecido por causa não relacionada. A cor azul representa o núcleo das células, a verde um marcador (S1009) de monócitos e macrófagos infiltrados no tecido e a vermelha, do receptor CD36. Macrófagos e monócitos que expressam tanto S1009 e CD36 aparecem em amarelo pela sobreposição dos dois – Foto: Reprodução/ Alexandre Fabro e Edismauro Freitas-Filho
Eficiência prejudicada
Na etapa seguinte, investigou-se o que acontecia com a expressão gênica do macrófago após ele fagocitar uma célula apoptótica infectada pelo sars-cov-2. Observou-se queda na expressão de genes-chave para a atividade da célula de defesa, entre eles TIM4, SRA-I, CD36 e ITGB5.
“Esses genes codificam receptores [proteínas] que ficam na membrana do macrófago e reconhecem uma substância chamada fosfatidilserina, considerada o sinal universal de morte celular”, conta Larissa.
Como explica a pesquisadora, esse fosfolipídeo costuma estar presente na parte interna da membrana celular, mas quando as células morrem a fosfatidilserina passa para a superfície externa, podendo então ser detectada pelo macrófago por meio de receptores como TIM4 e CD36.
“Para promover o reparo eficiente de lesões e evitar o acúmulo de material necrótico no organismo, os macrófagos devem ser capazes de reconhecer e remover continuamente as células mortas, uma na sequência da outra. Contudo, nossos experimentos mostraram que, ao internalizar uma célula apoptótica que contém o sars-cov-2, essa capacidade fagocítica é significativamente reduzida”,
conta Cunha.

Fernando de Queiroz Cunha -Foto: Arquivo pessoal
Quando células epiteliais mortas por radiação foram colocadas nas culturas de macrófagos, aqueles que haviam tido contato prévio com células infectadas pelo vírus se mostraram 12 vezes menos capazes de cumprir a função de limpeza.
Em outro teste, uma cultura de macrófagos humanos foi infectada diretamente pelo sars-cov-2. Também nesse caso houve redução da atividade fagocítica, mas de apenas duas vezes.
Células de pacientes
Análises feitas em amostras sanguíneas de pacientes com covid-19 moderada ou severa – coletadas no dia da internação – apontaram altos níveis de moléculas pró-inflamatórias, como IL-6, IL-1β, além de interleucina 8 (IL-8) e interleucina 10 (IL-10). Também foi observado, em comparação com o sangue de voluntários sadios, um aumento na proporção de monócitos circulantes (leucócitos que dão origem aos macrófagos) e, nesse grupo de células, uma maior proporção de monócitos com fenótipo pró-inflamatório.
A análise de expressão gênica indicou que os monócitos dos pacientes com covid-19 expressavam em menor quantidade os receptores CD36, SRA-I, ITGB5 e TIM4, quando comparados aos monócitos dos voluntários sadios. E, quanto mais graves eram os sintomas relatados no momento da admissão hospitalar, mais acentuada era a queda na expressão dos receptores fagocíticos, relatam os autores do artigo.
No teste subsequente, os monócitos dos pacientes com covid-19 foram “desafiados” in vitro com células apoptóticas de camundongo. Como esperado, foram bem menos eficientes na tarefa de limpeza do que os monócitos isolados do sangue de voluntários sadios.
Com auxílio de ferramentas de bioinformática, por meio de uma colaboração com o professor da USP Helder Nakaya, os pesquisadores reanalisaram dados de expressão gênica de estudos anteriormente publicados, disponíveis em bancos públicos. A análise confirmou que, nos pacientes com a forma grave da covid-19, a redução na expressão dos genes que promovem fagocitose de células mortas é bem mais acentuada do que nos doentes com sintomas leves.
Por último, foram analisadas células de defesa infiltradas em amostras de pulmão de pessoas que morreram de covid-19, obtidas por meio de autópsia. “Olhamos para células mononucleares que haviam sido recrutadas da circulação para combater o vírus no pulmão. Também nesse caso observamos queda na expressão dos receptores, o que sugere que essas células de defesa estavam com a capacidade fagocítica comprometida”, conta Cunha.
Segundo os autores, a falha na remoção de células mortas pode contribuir para o extenso dano aos tecidos observado nos pulmões de pacientes com covid-19. “Isso, dentre outros fatores, pode favorecer complicações respiratórias desenvolvidas por indivíduos com a forma grave da doença e aumentar a suscetibilidade a infecções bacterianas secundárias”, concluem.
O trabalho contou com a participação da equipe do Centro de Pesquisa em Doenças Inflamatórias (Crid) – um Centro de Pesquisa, Inovação e Difusão (Cepid) da Fapesp –, além de médicos e pesquisadores do Hospital das Clínicas da FMRP. Entre os autores do artigo estão os professores Fernando Q. Cunha, Alexandre T. Fabro, Helder Nakaya, Dario S. Zamboni, Paulo Louzada-Junior e Rene D. R. Oliveira.
O artigo Efferocytosis of SARS-CoV-2-infected dying cells impairs macrophage anti-inflammatory programming and continual clearance of apoptotic cells pode ser lido neste link.
Este texto foi originalmente publicado por Agência Fapesp de acordo com a licença Creative Commons CC-BY-NC-ND. Leia o original aqui.
A reprodução de matérias e fotografias é livre mediante a citação do Jornal da USP e do autor. No caso dos arquivos de áudio, deverão constar dos créditos a Rádio USP e, em sendo explicitados, os autores. Para uso de arquivos de vídeo, esses créditos deverão mencionar a TV USP e, caso estejam explicitados, os autores. Fotos devem ser creditadas como USP Imagens e o nome do fotógrafo.